发布时间:2024-12-10 浏览:114次
(本文来源于Elva Wang人体微生态管理公众号)

【概述】
本文是一篇关于短链脂肪酸(SCFAs)的综述文章,探讨了饮食、微生物群和免疫系统之间的关系。文章主要关注了SCFAs在肠道及身体其他部位如何影响粘膜屏障功能、粘膜免疫和系统免疫,以及它们在肠内和肠外疾病的治疗潜力。
1.SCFAs的产生和影响因素
SCFAs如丁酸、丙酸和乙酸是微生物代谢物,其在肠道和其他器官的可用性受到环境因素的影响,如饮食和抗生素使用。
2.SCFAs的免疫调节作用
SCFAs通过进化保守的途径调节粘膜屏障功能和粘膜免疫以及系统免疫,包括G蛋白偶联受体信号传导和组蛋白去乙酰酶活性。
3.SCFAs在肠道免疫紊乱中的作用
肠道来源的SCFAs直接和间接影响肠道以外的部位(如肝脏、肺部、生殖道和大脑)的免疫应答,并与一系列疾病有关。
4.SCFAs的治疗潜力
通过生态学理解和工程化产丁酸细菌,可以支持以SCFAs为重点的预防和治疗免疫介导疾病的干预。
#01
文献研究核心论点
短链脂肪酸(SCFAs)在免疫系统中的作用及影响因素
短链脂肪酸是微生物代谢产物,在肠道和其他器官中由环境因素如饮食和抗生素使用决定其可用性。
SCFA通过进化保守的过程调节上皮屏障功能以及粘膜和全身免疫力,并且但丁酸的作用主要通过对肠上皮细胞、吞噬细胞、B细胞和浆细胞,以及调控性和效应T细胞的不同化直接发挥作用。
肠道来源的SCFA也直接影响到肠道以外的部位如肝脏、肺部、生殖器和大脑的免疫反应,并与一系列疾病有关联。
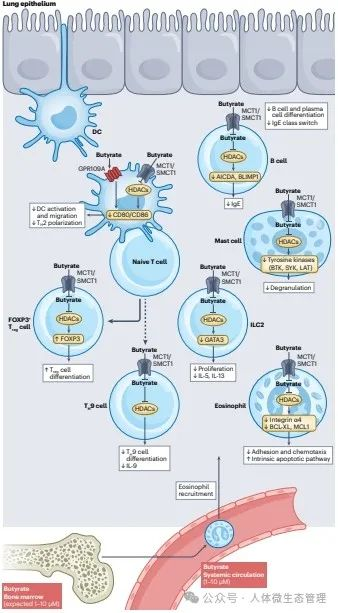
图:丁酸盐在肺粘膜免疫中的作用。在肺上皮层,肺微生物群很少局部产生丁酸盐,但肠源性丁酸盐在进入肺粘膜之前通过对骨髓前体细胞和血源性细胞的影响间接影响肺免疫和对呼吸道感染的易感。骨髓和血液中肠源丁酸盐的水平在1µ~ 10 μΜ之间。丁酸酯通过降低共刺激分子CD80和CD86的表达下调树突状细胞(DC)的迁移和激活,从而限制过敏性T辅助2 (TH2)细胞的反应。此外,丁酸盐调节幼稚T细胞向TH9细胞和调节性T细胞(Treg)的分化,例如,通过上调转录因子FOXP3。丁酸盐还通过下调转录因子AICDA和BLIMP1的表达来抑制B细胞和浆细胞的分化;由于酪氨酸蛋白激酶BTK、SYK和LAT的下调,与IgE应答的肥大细胞脱颗粒减少有关;下调转录因子GATA3可降低2型先天淋巴细胞(ILC2)的增殖和细胞因子的产生;并抑制嗜酸性粒细胞粘附血管内皮,同时也促进肺嗜酸性粒细胞凋亡。HDAC,组蛋白去乙酰化酶;诱导髓性白血病细胞分化蛋白1;MCT1,乳酸转运蛋白单羧酸转运蛋白1;SMCT1,钠偶联单羧酸转运蛋白1。
SCFAs水平的影响因素及其对人体健康的影响
生活方式的变化会影响人体内SCFAs的产生,例如高纤维食物摄入可增加体内SCFAs含量;而低纤维食品则会导致SCFAs减少。
抗生素使用的增多会破坏人类体内的共生菌群平衡,导致SCFAs水平下降,进而可能引发慢性免疫介导性疾病的发生率上升。
感染病毒也可以改变宿主微生态系统的丰富度和多样性,从而影响SCFA生物合成。
SCFAs诱导的细胞信号传导机制
SCFAs可以通过表面表达自由脂肪酸受体或G蛋白偶联受体(GPCR),或者通过抑制组蛋白去乙酰基酶(HDAC)活性来发挥它们的功能。
GPR41广泛存在于多种组织中,而GPR43主要在淋巴结组织和各种免疫细胞中表达。这些GPCR对于不同类型的SCFAs有不同的亲合力,这使得不同的SCFAs能够在多个靶点上起着各自独特的作用。
环境因素驱动微生物代谢与多样性影响短链脂肪酸产生及炎症
文本讨论了环境和宿主因素如何改变肠道菌群的组成和代谢能力。
许多这些因素已被证明会影响丁酰细菌群体(如Faecalibacterium prausnitzii)、Anaerostipes spp.、Roseburia spp. 和 Eubacterium spp.以及肠内丁酸水平和其他短链脂肪酸(SCFAs)的生产。
SCFAs对巨噬细胞的影响
SCFAs直接作用于树突状细胞(DCs),以增强其免疫调节特性。
但在活动性IBD期间使用但醋可能具有特定的情况依赖性的效果,在这种情况下它可能会阻止炎症反应而不是抑制它们。
但是,尽管但它在稳态下有抗炎性和保护性屏障的效果,但在TNF相关过度炎症的情况下却无法抑制炎症反应。
短链脂肪酸(SCFAs)在免疫细胞功能中的调节作用
SCFA如丁酰胺通过激活PI3K-AKT和mTOR信号通路促进肠道ILC1s和ILC3s的增殖,并同时抑制肠内ILC2s的扩张。
丙酸增加体内结肠产生IL-22的ILC3数量是通过GPR43信号传导实现的;而但醋则刺激RORγt+ ILC3s产生的IL-22,这是通过GPR41信号传导及组蛋白去乙酰基酶(HDAC)抑制来完成的。
SCFAs能够调控结肠内的I浆细胞(plasticity),维持胃黏膜屏障完整性,防止组织损伤、感染以及免疫病理学的发生。
SCFAs与炎症性肠病(IBD)的关系及其治疗潜力
IBD是由肠道中针对微生物群成分失调引起的慢性炎性疾病,其特征为异常强烈的炎症反应。
研究发现,在IBD患者的大便样本中,产丁酸菌的数量减少且水平降低,这可能是因为炎症导致了细菌摄取丁酸的能力下降。
直接给药或使用含有SCFAs的食物补充剂可能会成为一种有效的治疗方法,但是还需要更多的临床试验来验证这一假设。
SCFAs在预防肠道外疾病方面的作用
研究表明,母乳中含有大量的丁酸和其他SCFAs,这些物质有助于保护婴儿免受食物过敏的影响。
高纤维饮食可提高儿童体内的丁酸和乙酸含量,从而增强视黄醇活性并在CD103+树突状细胞(DCs)中发挥抗过敏效应。
对于患有特应性皮炎(atopic dermatitis)的孩子来说,富含SCFAs(尤其是丁酸)的饮食可以帮助改善皮肤状况,并减轻由致敏原引发的症状。
肠道微生物产生的短链脂肪酸(SCFAs)在免疫调节中的作用
肠道微生物通过产生SCFAs来影响宿主的免疫反应。
在非酒精性脂肪肝病的小鼠模型中,但丁抑制NF-κB介导的炎症,并有助于疾病缓解。
提供了早期抗生素治疗显著降低小鼠肝脏内SCFAs水平的例子,这导致受损的IL-18信号传导以及转录因子GATA3下调。
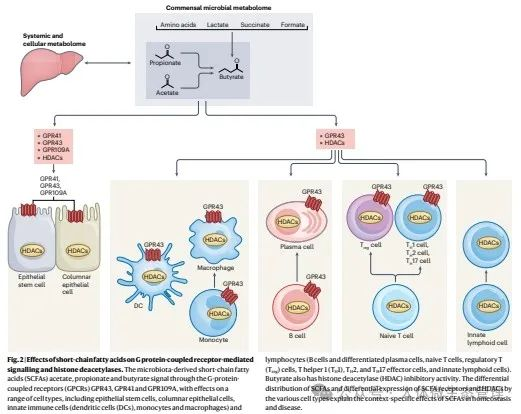
图:短链脂肪酸对G蛋白偶联受体介导的信号传导和组蛋白去乙酰化酶的影响。微生物群来源的短链脂肪酸(SCFAs)醋酸盐、丙酸盐和丁酸盐通过G蛋白偶联受体(GPCRs)GPR43、GPR41和GPR109A进行信号传递,对包括上皮干细胞、柱状上皮细胞、先天免疫细胞(树突细胞(DCs)、单核细胞和巨噬细胞)等多种细胞类型产生影响。淋巴细胞(B细胞和分化后的浆细胞、初始T细胞、调节性T细胞(Treg)、辅助性T细胞1型(TH1)、TH2和TH17效应细胞以及先天淋巴细胞)。丁酸盐还具有组蛋白去乙酰酶(HDAC)抑制活性。不同细胞类型中短链脂肪酸的分布差异以及SCFA受体和HDAC表达的差异解释了短链脂肪酸在稳态和疾病中的特定作用。
SCFAs对人体其他部位的影响及潜在应用
SCFAs不仅由肠道菌群产生并通过系统传播,在皮肤和女性生殖道也本地生产。
局部SCFAs具有组织特异性机制,可以通过不同的方式调控免疫耐受。
对于人类神经系统的保护效果已经在多种神经系统疾病的临床试验中得到证实。
饮食与SCFAs的关系及其对健康的影响
高纤维饮食或口服补充物可增加人体内的SCFAs含量。
婴儿期使用抗生素会明显减少体内SCFAs水平,而这些细菌能够刺激巨噬细胞分泌IL-18以恢复幼年时期被抗生素破坏的自然杀伤(NK)细胞成熟状态。
某些循环体外环境如肺部环境中也有少量的SCFAs存在,它们主要通过其对骨髓前体细胞的作用间接地影响呼吸感染的发生和发展情况。
短链脂肪酸(SCFAs)在免疫调节中的作用
短链脂肪酸是细菌代谢产物,在肠道微生物群与宿主之间起着桥梁的作用。
随着越来越多的研究发现炎症性肠病和其他自身免疫性疾病的发生率增加,这可能与菌群失调以及产生SCFAs特别是丁酰胺水平降低有关。
调节丁酰胺水平能够操纵模型系统中的炎性反应,并且靶向SCFA代谢有可能预防疾病并在免疫介导的紊乱中维持缓解状态。
饮食习惯影响人体健康及肠道菌群平衡
摄入高纤维食物如全谷物食品可促进有益菌生长,从而提高身体健康状况。
抗生素使用可能会导致体内益生菌数量减少,进而引发一系列健康问题。
婴儿期的食物摄入方式也会影响其肠道菌群的发展和结构形成。
短期抗生素暴露可能导致儿童过敏症风险上升
在婴儿早期接触抗生素会改变他们的肠道微生态,增加了他们患哮喘和过敏的风险。
这些研究结果强调了孕妇或新生儿期间合理用药的重要性,以防止长期不良效应的影响。
SCFAs与其他生理过程的关系及其对人体健康的潜在影响
SCFAs不仅参与能量代谢,还通过多种机制影响人类健康,例如调控基因表达、增强抗肿瘤免疫力等。
对于某些遗传性疾病来说,比如先天性氯化钠腹泻和家族性腹泻综合征,特定类型的SCFAs具有治疗潜力。
此外,一些研究表明,性别也可能影响到抗生素对肠道菌群和SCFA生成的影响。
肠道微生物及其代谢产物在炎症性肠病中的作用
肠道微生物产生的短链脂肪酸(SCFAs)如丁酰胺能够促进Th细胞产生IL-10以维持肠道稳态。
短链脂肪酸通过抑制组蛋白去乙酰化酶和调控mTOR-S6K途径诱导效应T细胞和调节性T细胞。
微生物衍生的短链脂肪酸能调节免疫细胞IL-22产量以及肠道免疫力。
饮食纤维对抗感染性疾病的作用
饲料纤维可以通过塑造Ly6c-patrolling巨噬细胞造血及CD8+ T细胞的新陈代谢来保护免受流感侵害。
消费者来源的微生态制剂可提高记忆潜力,并增强抗原激活的CD8+ T细胞的功能。
营养与免疫系统的相互关系
婴儿期母乳喂养或早期抗生素暴露可能会影响儿童后期患炎性肠病的风险。
生活方式因素如高纤维饮食也可能改变婴儿期肠道细菌群落结构,从而影响后代的过敏风险和发展情况。
益生菌的应用研究进展
益生菌补充剂已被证明有助于预防早产儿败血症和其他严重病症的发生率降低。
制药公司正在开发利用工程化的益生菌产品用于治疗各种慢性疾病,例如溃疡性结肠炎和非酒精性肝硬化等。
#02
短链脂肪酸(SCFAs)的十问十答
1.哪些因素会影响肠道微生物的多样性并进而影响短链脂肪酸(SCFAs)的生成?
多种环境和宿主因素可以影响肠道微生物的多样性和活性,并进一步影响SCFAs的生产。这些因素包括出生时的胎龄、分娩方式、喂养模式以及抗生素使用等。例如,母乳喂养与特定细菌如双歧杆菌在婴儿肠道中的丰富度有关联;而广谱抗生素的使用则可以直接减少肠道内SCFAs的水平。
2.SCFAs是如何通过表面表达的自由脂肪酸受体或G蛋白偶联受体进行信号传导的?
SCFAs可以通过表面表达的自由脂肪酸受体或者G蛋白偶联受体(GPCR),如GPR41、GPR43和GPR109A,在各种细胞上进行信号传导。激活这些GPCR会抑制依赖于环磷酸腺苷(cAMP)的信号途径,并同时激活其他信号路径,比如下游于GPR41、GPR43和GPR109的哺乳动物雷帕霉素靶蛋白(mTOR)信号通路。
3.丁酸如何通过调控组蛋白去乙酰化酶(HDAC)活动来发挥其效应?
当SCFAs进入细胞后,它们能够直接绑定到胞内的HDAC并且抑制其活性。此外,低浓度下的丁酸和丙酸还可以通过代谢成乙酰辅酶A,作为组蛋白乙酰转移酶(p300)的一种乙酰供体,从而增强组蛋白的乙酰化程度。
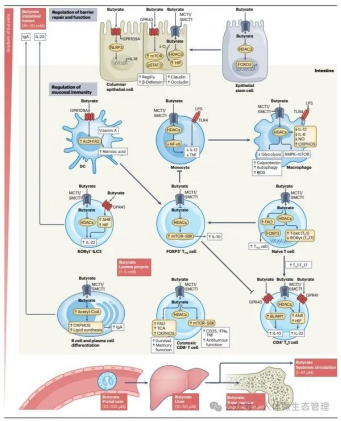
图:丁酸在肠道粘膜免疫中的作用。丁酸通过多种机制调节肠道粘膜屏障的完整性和功能。在肠腔中,丁酸浓度可达10mM至20mM,是肠道上皮细胞的关键能量来源。在柱状上皮细胞中,丁酸通过G蛋白偶联受体(GPR41、GPR43或GPR109A)和组蛋白去乙酰化酶(HDAC)抑制信号来激活NLRP3炎症小体,并诱导下游IL-18表达以维持稳态的粘膜免疫,以及表达抗菌肽和紧密连接蛋白claudin和occludin。此外,丁酸通过增加转录因子FOXO3启动子活性来控制上皮干细胞的周转和凋亡。在固有层中,丁酸水平介于1mM到5mM之间,调节免疫细胞归巢和分化、改变促炎和抗炎细胞因子产生的平衡以及诱导巨噬细胞的抗菌活性和吞噬活性。丁酸抑制单核细胞和巨噬细胞中促炎细胞因子的转录,如IL-12和肿瘤坏死因子(TNF),增加抗菌肽和钙保护蛋白(S100A8/S100A9)的产生,丁酸盐通过调节细胞代谢来诱导自噬。此外,丁酸盐控制着第三类先天淋巴细胞(ILC3)亚群的可塑性并增加IL-22的产生。丁酸盐还可以塑造适应性免疫。短链脂肪酸(SCFAs)可以直接作用于树突细胞(DCs)以增强其免疫调节特性。丁酸盐和丙酸盐抑制了体外人类单核细胞衍生的树突细胞的LPS诱导的成熟过程,减少了IL-12的产生并限制了随后的CD8+T细胞激活。它影响B细胞和浆细胞的分化以及肠道IgA的产生,在调节性T(Treg)细胞的分化过程中支持FOXP3表达和IL-10分泌,并通过上调T-bet表达和下调RORγt来增加辅助性T1(TH1)细胞与辅助性T17(TH17)细胞的比率。少量的丁酸盐通过门静脉(其中丁酸盐浓度在10μM和100μM之间)离开肠道并到达肝脏(其中丁酸盐浓度在10μM和50μM之间),然后进入全身循环和骨髓,在那里估计丁酸盐水平低至1μM到10μM。AHR,芳烃受体;DC,树突细胞;FAO,脂肪酸氧化;HIF,缺氧诱导因子;IFN,干扰素;LPS,脂多糖;MCT1,乳酸转运蛋白单羧酸转运蛋白1;mTOR,雷帕霉素靶蛋白的机制;NO,一氧化氮;OXPHOS,氧化磷酸化;ROS,活性氧物种;SMCT1,钠偶联单羧酸转运蛋白1;TCA,三羧酸循环;TLR,Toll样受体。
4.SCFAs对免疫系统有哪些调节作用?
SCFAs通过对免疫和非免疫细胞的目标的影响,帮助维持粘膜屏障功能,影响单核巨噬细胞和树突状细胞的抗菌和炎症特性,并且具有抗炎和平稳淋巴细胞的效果。
5.SCFAs如何参与维护黏膜屏障的功能?
SCFAs通过GPCR作用于肠干细胞、柱状细胞及内分泌细胞,同时也通过他们的抑制性效果发挥作用,以保护和修复胃肠道的黏膜屏障。
6.SCFAs在肠道以外的地方有什么作用?
除了在肠道内部的作用外,来源于肠道的SCFAs还直接影响了肝脏、肺部、生殖道和大脑等多个部位的免疫力,并且已经涉及到一系列疾病的研究,包括感染、肠道炎症、自身免疫性疾病、食物过敏症、哮喘以及癌症治疗反应等。
7.SARS-CoV-2病毒感染会对肠道菌群及其产生的SCFAs有何影响?
SARS-CoV-2病毒会导致肠道菌群失衡,特别是减少了支持发酵的有益菌株数量,增加了机会致病菌的数量,这可能会导致肠道内SCFAs合成能力下降。
8.饮食习惯如何影响人体内SCFAs的水平?
高纤维的地中海式饮食能够增加肠道内SCFAs的水平,因为这种饮食提供了更多的细菌发酵底物。相反地,西方化的饮食习惯——富含饱和脂肪、盐分和精制碳水化合物,缺乏水果蔬菜,则可能导致SCFAs产量降低。
9.遗传因素是否也会影响个体体内SCFAs的代谢过程?
有研究表明生物性别可通过睾酮和雌激素对肠道菌群造成直接影响,而这两种荷尔蒙又可间接影响SCFAs的代谢。另外,一些罕见的常染色体隐性遗传病也可能影响SCFAs的代谢,如先天性腹泻和自发性肠道炎症。
10.SCFAs在预防和治疗免疫介导疾病方面有可能起到什么作用?
由于SCFAs能显著影响粘膜和全身免疫应答,并且与许多炎症和过敏疾病的发病率密切相关,因此他们被认为可能成为预防和治疗免疫介导疾病的新策略之一。未来研究将聚焦于更深入理解SCFAs的功能机制,以便更好地利用这一发现为相关疾病的管理提供新的治疗方法。
信息量有点大,咱们逻辑思维一下
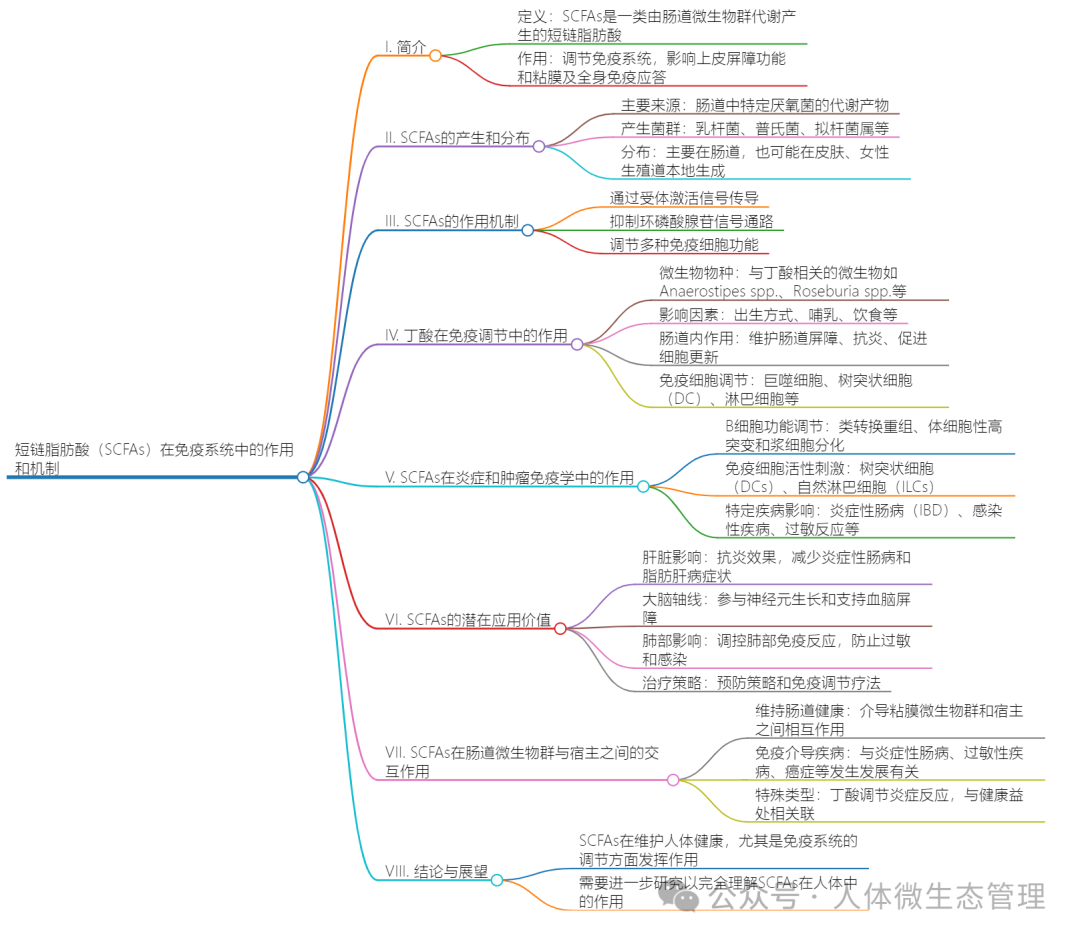
【总结】
文章的核心观点是SCFAs是肠道微生物群代谢产生的重要分子,它们通过多种机制影响粘膜和系统的免疫反应。SCFAs的水平受到饮食、生活方式等环境因素和遗传因素的影响。这些分子在维持粘膜屏障的完整性、调节炎症和促进免疫耐受方面发挥着关键作用,并与肠内外多种疾病的病理状态相关。因此,深入研究SCFAs的生物学功能对于理解免疫介导疾病的发展和寻找新的治疗方法具有重要意义。
#酒局守护神 #酉神1号 #酉神一号 #酉神壹号 #酒神1号 #酒神一号 #酒神壹号 #酉神1号解酒液 #酉神1号有机酸解酒液






